带你认识流式细胞术PART 3
更新时间:2025-12-02
浏览次数:218
单细胞样品制备样品制备
如果研究对象是体外培养的悬浮细胞,则直接收集细胞于离心管中,离心沉淀细胞,然后PBS清洗重悬沉淀,取适量于EP管中,标记染色相应的荧光素偶联抗体,最后洗去未结合的抗体,用适宜体积PBS重悬细胞进行上样;
荧光标记
荧光信号是流式细胞仪接受处理的主要信号;
流式细胞仪接收到的荧光信号主要来源于结合在样品细胞上的荧光素;
荧光素偶联抗体/染料与细胞结合后就会使细胞带有相应的荧光素,该荧光素被特定波长的激光激发后产生特定波长范围的荧光,分析该荧光信号的强弱就可间接反映样品细胞的某些特征;
荧光素
荧光素大都是一些化学试剂,有天然的、半天然的,也有人工合成的,有些是蛋白质。
荧光素产生荧光原理:荧光素(原子)在未被激发时外层电子处于基态,当被特定波长的激光激发后,外层电子接收到足够的能量就会跃迁到激发态,再回到基态同时释放荧光。
荧光素偶联抗体
由荧光素和抗体两部分组成,抗体一般是单克隆抗体。
偶联抗体产生荧光原理:在标记细胞时,荧光素偶联抗体中的抗体能与相应的抗原分子特异性结合,这时细胞表面就顺带结合了荧光素,同样被激光激发后产生荧光。
样品封闭
有些细胞表面受体会非特异性结合某些荧光素偶联抗体,产生混杂信号,导致流式分析结果错误,所以需要消除这种非特异性结合的影响。
方法:在荧光素偶联抗体标记前先封闭样品细胞。
具体:先用无关抗体孵育细胞,使细胞表面非特异性受体结合无关抗体,再用荧光素偶联抗体正常染色,保证所有的结合都是抗原与荧光素偶联抗体的特异性结合。
荧光素偶联抗体的标记方法
直接标记法:于单细胞悬液中加入适量的荧光素偶联抗体(保证荧光素偶联抗体与细胞相比相对过量),充分混匀,4℃静置孵育30min,然后用PBS洗去未结合的抗体,重悬细胞后就可以上样分析。
间接标记法:先用生物素偶联抗体标记样品细胞,再用荧光素偶联链霉亲和素标记样品细胞。此方法一般在多通道分析需要通道搭配以减少荧光素偶联抗体的种类时使用。
电压设定

目的:使细胞位于流式图的中心位置,防止细胞群接近边界而变形扭曲或者处于边界外;分隔开不同特征的细胞群。
原理:流式细胞仪利用光电倍增管将各通道检测到的荧光信号转变为电子信号,并在转变信号时按照一定比例提高电子信号的强度(提高倍数可以实时调控-即调节光电倍增管的电压)。电压设置越低,光信号转化时电子信号增强的倍数越小,得到的电子信号就越弱,反之亦然。
操作:通常使用阴性管或对照管的样品细胞进行初步调节,设置电压的基本原则是将荧光控制在数轴的1/4范围内,即该范围内的细胞都是阴性细胞,超过该范围的都是阳性细胞。根据此原则设置电压一般都能得到较为理想的流式图,从而能够得到较为准确的流式结果。后续实验组上样分析,若发现无法区分阴阳性细胞还需重新调整电压,对照管重新上样调整。
注意:如果各实验组的结果是根据阴性对照或同型对照的阴阳性界限得出的,那么一旦设定了对照管的电压,后面实验组上样时就不能再改变电压,否则会导致各实验组之间无可比性。
对照设置
阴性对照
目的:确定细胞的非特异性荧光。细胞表面不结合荧光素也会产生荧光信号,流式检测时得到的荧光信号是细胞本身的非特异性荧光和来自于细胞表面结合的荧光素的特异性荧光叠加的结果。
减一阴性对照FMO/单阳性对照(双色)
是指在多色多通道分析时对其中某一个通道特别设置的阴性对照,多在研究不同细胞亚群表达某些表型分子、细胞因子等时应用。
目的:精确界定不同细胞亚群各自的这一通道的阴阳性界限。因为不同细胞亚群的非特异性荧光可能存在差异,不同细胞亚群因结合不同的偶联抗体,他们补偿值可能存在差异,当在统一的补偿条件下同时分析时,不同细胞亚群在某一通道的阴阳性界限就可能存在差异,普通阴性对照无法进一步区分,而FMO就可以通过只缺少标记这一通道代表的荧光素偶联抗体来区分。
阳性对照
目的:检测该荧光素偶联抗体是否有效,排除假阴性结果。阳性对照并不是每次进行流式分析时都必须设置,一般在遇到以下情况时设置:
(1)初次使用的荧光素偶联抗体;
(2)换用不同公司或相同公司不同批号的荧光素偶联抗体;
(3)使用储存时间较长的荧光素偶联抗体;
以上三种情况都可能会因为各种原因导致荧光素偶联抗体失效,从而无法正常标记样品细胞,从而得到假阴性的结果。
补偿调节
因为不同荧光素被相同激光器激发后发出的波长可能会混有同波段的荧光信号,被收集后不同荧光信号之间会互相掺杂,为了区分开来就需要对各荧光信号之间进行补偿调节来还原真实的荧光信号值。
荧光补偿(fluorescence compensation)
*排除FL2中来自FITC的荧光信号,设置“FL2-FL1"(PE-FITC)的补偿值,使FL2代表PE的荧光信号;
*排除FL1中来自PE的荧光信号,设置“FL1-FL2"(FITC-PE)的补偿值,使FL1代表FITC的荧光信号,这一过程就是荧光补偿。
何时需要补偿调节

是否需要补偿调节以及如何具体安排补偿调节与实验目的有关。
单色分析标记一种荧光素偶联抗体时,不需要补偿调节。单色分析用FITC通道,标记FITC偶联的抗体,只需分析FITC通道接收的荧光信号的强弱即可,不需要分析其他通道(MFI实际值);
若是双色或多色分析,同时标记多种荧光素偶联抗体,这些通道之间就需要进行补偿调节。
影响补偿大小的因素
主要受仪器型号(滤光片)、荧光素偶联抗体、细胞这三方面因素的影响。
荧光通道之间的补偿没有一个固定的值。
补偿的具体方法-分组
以调节FITC通道和PE通道之间的补偿为例进行介绍。
样品细胞:小鼠脾脏细胞
抗体:FITC-抗CD8抗体、PE-抗CD4抗体
将细胞分成4份,具体标记方法和目的见下表:
| 样品序号 | 抗体标记方法 | 目的 |
| 1 | 不标记荧光素偶联抗体 | 阴性对照 |
| 2 | 标记FITC-抗CD8抗体 | 调节PE-FITC补偿 |
| 3 | 标记PE-抗CD4抗体 | 调节FITC-PE补偿 |
| 4 | 标记FITC-抗CD8抗体、标记PE-抗CD4抗体 | 观察补偿调节结果 |
一份样品细胞不标记任何荧光素偶联抗体,仅作为阴性对照,用于确定FITC、PE通道的阴阳性分界。
补偿的具体方法-PE-FITC补偿
第二份样品只标记FITC-抗CD8抗体,用于调节PE-FITC补偿值。
未调节补偿时(PE-FITC补偿值为0)的FITC-PE散点图如下图A所示,不仅FITC通道能够接收到FITC荧光素发射的信号,PE通道也能够接收到FITC荧光素发射的荧光信号,为了使FITC通道代表FITC荧光素的信号,PE通道代表PE荧光素的信号,需要将PE通道中接收到的来源于FITC荧光素的信号扣除,就是设置PE-FITC补偿(PE减FITC补偿)。
当设置的PE-FITC补偿越来越大时,PE接收到的来源于FITC荧光素的信号越来越少,直到如图B所示;
如图C所示是过度调节PE-FITC补偿值的FITC-PE散点图,FITC阳性细胞群PE通道信号明显低于FITC阴性细胞群。

第三份样品只标记PE-抗CD4抗体,用于调节FITC-PE补偿值。
未调节补偿时(FITC-PE补偿值为0)的FITC-PE散点图如下图D所示,不仅PE通道能够接收到PE荧光素发射的信号,FITC通道也能够接收到PE荧光素发射的荧光信号,为了使FITC通道代表FITC荧光素的信号,PE通道代表PE荧光素的信号,需要将FL1中接收到的来源于PE荧光素的信号扣除,就是设置FITC-PE补偿(FITC减PE补偿)。

如图E所示的是正确调节FITC-PE补偿值后的FITC-PE散点图,此时FITC通道基本接收不到来源于PE荧光素的信号,而且PE阴阳性细胞群处于同一垂直线上。
如图F所示是过度调节FITC-PE补偿值的FITC-PE散点图,PE阳性细胞群FITC通道信号明显低于PE阴性细胞群。
补偿的具体方法-补偿效果观察
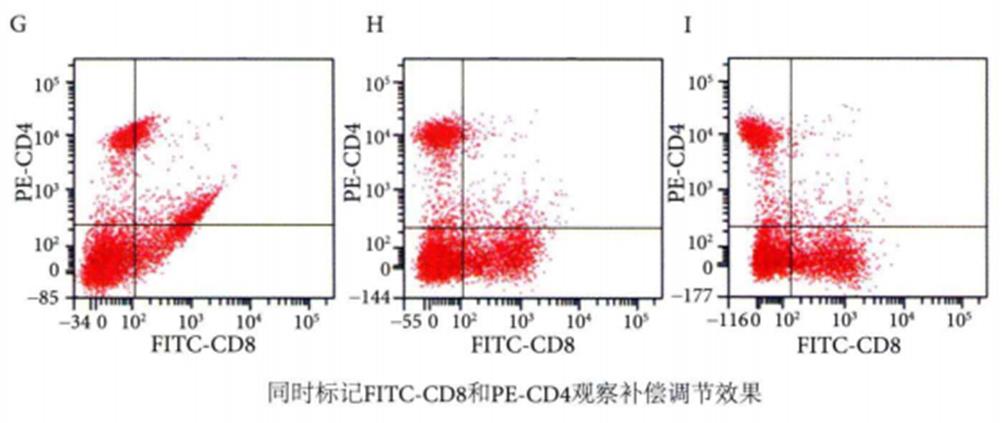
第四份样品同时标记FITC-CD8和PE-CD4抗体,用于观察补偿调节效果。
如图G所示的是未调节补偿时的FITC-PE散点图,FITC通道同时接收到FITC和PE荧光素发射的荧光信号;
如图H所示的是正确调节补偿后的散点图,FITC通道只接收到FITC荧光素发射的荧光信号,PE通道只接收到PE荧光素发射的荧光信号,细胞分群较为清晰。
如图I所示的是过度调节补偿后的散点图。
调节荧光补偿要求
(1)正确选择具有代表性的荧光素偶联抗体用于调节荧光通道之间的补偿;
如需要调节FL1和FL2之间的补偿,就可以选择FITC荧光素偶联抗体、PE荧光素偶联抗体。
(2)选择的两个抗体所结合的抗原分子必须在样品细胞中有明确的表达(表达该抗原的细胞占有较高的比例);
若阳性细胞比例太低,就无法形成明显的细胞团,从而无法判断补偿调节是否得当;当然比例应不能过高,这样不表达该抗原分子的细胞的荧光信号就可以作为阴性对照。
(3)细胞能够高表达该抗原;
这样才能使阳性细胞和阴性细胞明显分群。
阈值设定
流式分析的对象是细胞,而上样分析时的样品中不可避免存在着或多或少的细胞碎片。虽然碎片一般都比较小,但仪器无法判断检测到的对象是碎片还是细胞(实验者当然只希望分析目的细胞),这时候就需要通过设定阈值尽可能的排除细胞碎片或其他小颗粒物质的影响,使流式分析的对象只是细胞。
如何设定阈值(threshold)
设定阈值首先需要确定触发通道(根据某个涉及的通道来设定),常用的是FSC通道(一般细胞碎片都比细胞小,根据FSC大小设定阈值来排除碎片比较理想)。
阈值由百分数来表示,如4%(触发通道若是FSC就表面每检测到100个对象就会自动排除其中FSC最小的4个对象);设定阈值只是一个经验值,并不是设定了阈值就可以绝对排除掉细胞碎片等等,需根据实验实际情况调节阈值(比如制备样本细胞不理想时间过长就可以相应提高阈值)。
死细胞排除
样品细胞中一般含有一定量的死细胞,通过一定的方法可以减少死细胞比例,但是去除干净几乎是不可能的。流式分析的目标是活细胞,若流式分析时误将死细胞当成活细胞来分析,会严重影响流式结果。
如何减少/排除死细胞
制备阶段:尽量缩短样本制备时间,使用缓冲液等等手段保持细胞活力。
分析阶段:目前有四种常见的方式区分活/死细胞,如:对角线死细胞、7AAD标记、PE-Cy5通道非标记阳性细胞、EMA与ViD标记死细胞。
7AAD(7氨基放线菌素D)标记
7AAD是一种非渗透性(无主动性)的核酸标记染料,若细胞死亡,代谢停止导致质膜受损,从而该染料能进入细胞内,一旦与细胞内暴露的DNA结合,就和形成高强度荧光的加合物,从而被荧光通道接收(即7AAD阳性表面细胞死亡)。
7AAD发射的荧光比较集中,一般被PerCP通道接收,基本不与FITC、PE荧光重叠,可以与FITC、PE共同标记样本细胞(优于PI)。
7AAD不能与PerCP或PE-Cy5偶联的抗体共同标记样品细胞。标记7AAD不需要与其他荧光素偶联抗体同时标记,只需要在流式上样前加入适量7AAD于上样管中即可。分析时,只需将PerCP通道阴性的细胞设门显示于新的流式图中即为正常的活细胞。
分析速度控制
流式细胞仪的液流系统由样品流和鞘液流组成,虽然样品流和鞘液流相互接触,但是这两个液流却是相互独立的,分别由两个压力所控制。鞘液压力是不变的,而一般改变样品流压力从而调节上样速度。
原理:为形成稳定的层流,需保证样品流和鞘液流的流速是相同的。改变样品流压力,改变样品流的直径。增加样品流压力,位于中间的样品流的直径就会增大,单位时间内流过的细胞就会增加。
实际操作:流式分析对上样速度要求不高,一般只简单的设置几档分析速度供选择,如Low、Medium和High。低速上样时,样品压相对较小,样品流直径较小,样品流内的细胞位于液流正中的概率更大,分析得到的数据接近细胞的真实数据,但是,耗时较长,就不适用于样品组数较多的情况。如果样品组数较少,时间不是主要考虑因素,则尽量低速分析。



